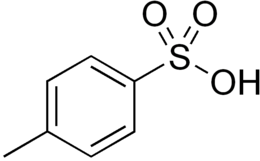
Acido p-toluensolfonico

| Acido p-toluensolfonico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido 4-metilbenzensulfonico | |
| Nomi alternativi | |
| acido p-toluensolfonico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH3C6H4SO3H |
| Massa molecolare (u) | 172,20 g/mol |
| Aspetto | solido bianco cristallino |
| Numero CAS | 104-15-4 |
| Numero EINECS | 203-180-0 |
| PubChem | 6101 e 20307553 |
| DrugBank | DBDB03120 |
| SMILES | CC1=CC=C(C=C1)S(=O)(=O)O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 295 K | 6,30×102 |
| Temperatura di fusione | 106 °C (379 K) |
| Temperatura di ebollizione | 140 °C (413 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 | |
| attenzione | |
| Frasi H | 315 - 319 - 335 |
| Consigli P | 302+352 - 304+340 - 305+351+338 [1] |
| Modifica dati su Wikidata · Manuale | |
L'acido p-toluensolfonico[2] (PTSA or pTsOH) o acido tosilico (TsOH) è un composto organico con formula CH3C6H4SO3H. A temperatura ambiente è un solido bianco, solubile in acqua, alcol ed altri solventi organici polari. Il gruppo CH3C6H4SO2― è anche conosciuto col nome di tosile e a volte viene abbreviato con la sigla Ts o Tos. Più spesso invece, con la sigla TsOH ci si riferisce alla forma monoidrata dell'acido, CH3C6H4SO3H . H2O.
È un acido forte (circa un milione di volte più dissociato dell'acido benzoico) e uno dei pochi ad esistere in stato solido a temperatura ambiente. Per questa sua caratteristica è spesso utilizzato in reazioni di chimica organica, ad esempio nell'esterificazione di acidi carbossilici.
Preparazione e usi
TsOH è preparato su scala industriale dalla solfonazione del toluene. Si idrata rapidamente. Le impurità comuni includono acido benzensolfonico e acido solforico. L'acido p-toluensolfonico monoidrato contiene acqua cristallina e acqua come impurità. Per stimare l'umidità totale presente come impurità, viene utilizzato il metodo Karl Fischer. Le impurità possono essere rimosse mediante ricristallizzazione dalla sua soluzione acquosa concentrata seguita da essiccazione azeotropica con toluene.[3]
TsOH trova impiego nella sintesi organica come catalizzatore acido "organico-solubile". Esempi di usi includono:
- Acetalizzazione di un'aldeide.[4]
- Esterificazione di acidi carbossilici.[5]
- Transesterificazione di un estere.[6]
Tosilati
Gli alchil tosilati sono agenti alchilanti poiché il tosilato è elettronattrattore, il che rende l'anione tosilato un buon gruppo uscente. Gli esteri di toluensolfonato subiscono attacco o eliminazione nucleofila. La riduzione degli esteri di tosilato dà l'idrocarburo corrispondente. Pertanto, la tosilazione seguita dalla riduzione consente la disossigenazione degli alcoli.
I tosilati proteggono anche il gruppo per gli alcoli. Sono preparati combinando l'alcool con 4-toluenesulfonil cloruro, di solito in un solvente aprotico, spesso piridina.[7]
Reazioni
TsOH può essere convertito in anidride p-toluensolfonica mediante riscaldamento con pentossido di fosforo.[8] Se riscaldato con acido e acqua, TsOH subisce idrolisi in toluene:
Questa reazione vale per tutti gli acidi arilsolfonici.[9][10]
Note
- ^ Scheda del composto su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019). consultata il 4.06.2020
- ^ leggi: para-toluensolfonico
- ^ Perrin, D. D. e Armarego, W. L. F., Purification of Laboratory Chemicals, Oxford, Pergamon Press, 1988.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=v77p0236 Titolo mancante per url
url(aiuto). - ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv9p0722 Titolo mancante per url
url(aiuto). - ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv8p0201 Titolo mancante per url
url(aiuto). - ^ Nucleophilic Substitution, su chem.ucalgary.ca.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv4p0940 Titolo mancante per url
url(aiuto). - ^ C. M. Suter, The Organic Chemistry of Sulfur, New York, John Wiley & Sons, 1944, pp. 387–388.
- ^ J. M. Crafts, Catalysis in concentrated solutions, in J. Am. Chem. Soc., vol. 23, 1901, pp. 236–249.
Voci correlate
Altri progetti
Altri progetti
- Wikimedia Commons
 Wikimedia Commons contiene immagini o altri file su acido p-toluensolfonico
Wikimedia Commons contiene immagini o altri file su acido p-toluensolfonico
 Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia
Portale Chimica: il portale della scienza della composizione, delle proprietà e delle trasformazioni della materia












